Menurunnya angka kematian di ICU telah meningkatkan angka harapan hidup pasien kritis yang dirawat di unit perawatan intensif. Namun, kumpulan gejala yang timbul pada pasien-pasien yang lepas rawat dari ICU pun bermunculan. Kumpulan gejala ini tidak hanya mempengaruhi pasien sendiri, tetapi juga mempengaruhi keluarga pasien. Kumpulan gejala ini terangkum dalam Sindrom Pascarawat Intensif (Post-Intensive Care Syndrome : PICS)
Pendahuluan
Angka kematian di ICU telah menurun dari waktu ke waktu, meskipun usia dan tingkat keparahan penyakit pada populasi pasien cenderung meningkat. Sebaliknya, populasi pasien yang selamat dengan berbagai gejala sisa jangka panjang dari penyakit kritis terus bertambah. Meskipun secara historis penelitian-penelitian hanya berfokus pada mortalitas jangka pendek, semakin banyak data didapatkan tentang tingginya morbiditas terkait dengan kelangsungan hidup pasien setelah dirawat di ICU. Hal ini menunjukkan bahwa kelangsungan hidup tidak selalu sama dengan pemulihan.1,2,3
Efektivitas perawatan intensif harus dievaluasi tidak hanya berdasarkan kelangsungan hidup jangka pendek setelah penyakit kritis, namun juga pemulihan ke kualitas hidup yang memadai. Meningkatnya bukti disabilitas fungsional jangka panjang pada pasien yang selamat dari perawatan intensif mengarah pada definisi sindrom pascarawat intensif. Diagnosis dini dan pengobatan yang efektif untuk kondisi yang baru dikenali ini diperlukan. Namun, sebagian besar upaya awal untuk membatasi gejala sisa jangka panjang belum membuahkan hasil yang memuaskan.4

Sindrom Pascarawat Intensif telah dikenal selama lebih dari satu dekade dan didefinisikan sebagai munculnya gangguan baru atau memburuknya kesehatan fisik, psikologis, atau kognitif, atau kombinasinya, setelah penyakit kritis. Setelah keluar dari rumah sakit, hingga 80% pasien yang selamat dari ICU dapat mengalami gejala Sindrom Pascarawat Intensif, dan meskipun Sindrom Pascarawat Intensif dapat membaik seiring berjalannya waktu, lebih dari separuh pasien akan terus mengalami gejala dalam waktu 1 tahun.1,5
Pandemi COVID-19 telah membawa perhatian yang sangat dibutuhkan pada kondisi ini, dan permintaan untuk perawatan pascarawat intensif telah meningkat. Dalam referat ini akan dibahas mengenai manifestasi klinis Sindrom Pascarawat Intensif dan dampaknya terhadap pasien, keluarga, dan sistem perawatan kesehatan akan dibahas. Serta hubungan antara Sindrom Pascarawat Intensif dan faktor penentu sosial kesehatan serta menguraikan kerangka kerja untuk evaluasi dan manajemen Sindrom Pascarawat Intensif.1,6
Definisi
Sindrom Pascarawat Intensif (Post-Intensive Care Syndrome – PICS) adalah manifestasi kolektif dari gangguan fisik, gangguan kognitif, dan masalah kesehatan mental berkepanjangan yang terjadi selama atau setelah dirawat di unit perawatan intensif (ICU) dan tidak hanya berdampak pada hasil jangka panjang pasien ICU tetapi juga kesehatan mental pasien dan keluarga.7
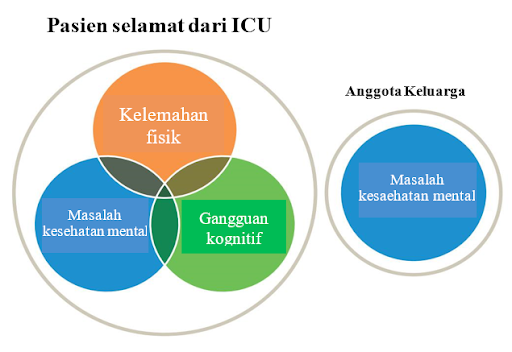
Dikutip dan dimodifikasi dari: Nakanishi N, Liu K, Kawakami D, et al. Post-intensive care syndrome and its new challenges in coronavirus disease 2019 (COVID-19) pandemic: a review of recent advances and perspectives. J Clin Med. 2021;10(3870):1-17.
Epidemiologi
Gejala PICS individual dilaporkan terjadi pada 50-70% pasien sakit kritis, dan gejala serupa juga terjadi pada 20% pasien. Diketahui bahwa kualitas hidup pasien menurun seiring dengan timbulnya PICS, dan sekitar dua pertiga, dua perlima, dan sepertiga dari pasien yang pernah dirawat di ICU menjadi pengangguran hingga 3, 12, dan 60 bulan setelah keluar dari rumah sakit. Faktor penyebab PICS secara luas dapat diklasifikasikan menjadi faktor intervensi, lingkungan, dan psikologis, termasuk berbagai pengobatan, seperti ventilasi mekanis, lingkungan asing, dan stres yang luar biasa selama pengobatan. Selain itu, dalam masyarakat lanjut usia saat ini, salah satu faktor risiko penting terjadinya PICS adalah kelemahan, yang merupakan tahap peralihan antara kesehatan normal dan keadaan di mana perawatan diperlukan. Kelemahan mencakup kelemahan fisik, seperti kelemahan otot yang diwakili oleh sarcopenia dan osteoporosis, dan kelemahan psikososial, seperti depresi dan disfungsi kognitif. Kelemahan sosial, isolasi dari aktivitas sosial, merupakan masalah serius lainnya di PICS.7
Mekanisme Sindrom Pascarawat Intensif
Meningkatnya angka kematian di ICU telah membuktikan bahwa penyintas penyakit kritis menghadapi sejumlah komplikasi parah dan gejala sisa jangka panjang yang dapat mengganggu kualitas hidup mereka. Beberapa faktor, termasuk penuaan populasi serta munculnya terapi invasif yang dapat meningkatkan luaran, telah meningkatkan minat terhadap kondisi jangka panjang ini. Pada tahun 2012 Sindrom Pascarawat Intensif didefinisikan sebagai “gangguan baru atau memburuk pada status kesehatan fisik, kognitif atau mental yang timbul setelah penyakit kritis dan menetap setelah perawatan akut di rumah sakit”. Perlu dicatat bahwa definisi ini memberikan kerangka kerja untuk meningkatkan kesadaran, penelitian dan pendekatan diagnostik dan terapeutik, bukan untuk mendefinisikan sindrom klasik.4
Sindrom Pascarawat Intensif mencakup beberapa dimensi, termasuk aspek fisik, kognitif dan emosional, yang sebagian besarnya tidak memiliki definisi standar atau kriteria diagnostik. Gejala sisa pernapasan jangka panjang meliputi gangguan volume paru, dinamika ventilasi, dan difusi. Meskipun beberapa penelitian melaporkan adanya gangguan ringan dalam sebagian besar kasus, pandemi COVID-19 baru-baru ini menyoroti relevansi gejala sisa pernapasan jangka panjang yang disebabkan sindrom gangguan pernapasan akut (ARDS).4
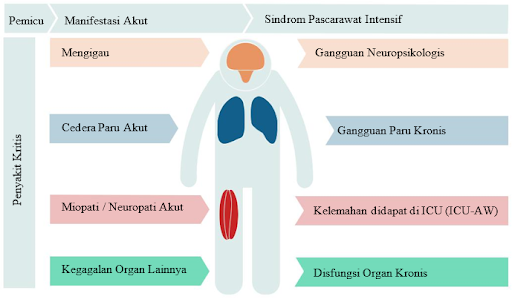
Dikutip dan dimodifikasi dari: Martin-Vicente P, López Martínez C, Lopez Alonso I, López Aguilar J, Albaiceta G, Amado Rodríguez L. Molecular mechanisms of postintensive care syndrome. Intensive Care Med Exp. 2021;9(58):1-17.
Gangguan muskuloskeletal termasuk dalam konsep “kelemahan yang didapatkan di ICU” (ICU Acquired Weakness – ICU-AW), yang didefinisikan sebagai “kelemahan otot umum yang menyebar, simetris, terdeteksi melalui pemeriksaan fisik dan memenuhi kriteria terkait kekuatan spesifik) yang berkembang setelah timbulnya penyakit kritis tanpa adanya penyakit lain yang dapat diidentifikasi." ICU-AW dapat mengakibatkan keterbatasan aktivitas sehari-hari dan penurunan kualitas hidup secara signifikan. Meskipun beberapa perbaikan mungkin terjadi pada tahun pertama setelah keluar dari ICU, kelemahan tetap ada pada sebagian besar kasus. Yang terakhir, perubahan neuropsikologis mengenai penurunan kognitif pada pasien yang selamat di ICU juga telah dijelaskan oleh beberapa penulis. Hingga 80% pasien sakit kritis mengalami delirium saat berada di ICU, dan sejumlah besar pasien yang selamat dari ICU menunjukkan tanda-tanda gangguan kognitif sedang atau kondisi kesehatan neurologis, emosional, dan mental lainnya yang terkait dengan PICS termasuk depresi, kecemasan, gangguan stres pascatrauma. dan gangguan kognitif. Sekali lagi, kekacauan ini dapat bertahan lama setelah tahun pertama dan menyebabkan keterbatasan aktivitas pasien.4
Mekanisme disfungsi paru kronis
Kebutuhan akan bantuan pernafasan merupakan salah satu alasan utama masuk ICU, baik karena cedera paru atau kegagalan ventilasi. Pasien yang sakit kritis ini seringkali memerlukan ventilasi mekanis. Kerusakan organ sebelumnya, bersama dengan penggunaan ventilasi, dapat menyebabkan timbul atau memburuknya cedera paru-paru, yang melibatkan disfungsi epitel penghalang, peradangan dan remodeling matriks. Dalam konteks ini, kegagalan untuk menyelesaikan proses-proses ini dengan benar dapat menyebabkan timbulnya gejala sisa jangka panjang. Namun, mekanisme spesifik yang menyebabkan kerusakan paru akut menjadi kronis masih belum sepenuhnya diketahui. Sebagian besar pengetahuan mengenai topik ini berasal dari penelitian tentang penyakit paru-paru kronis yang umum terjadi, seperti fibrosis paru idiopatik, yang dapat menggambarkan adanya mekanisme patogenetik yang mendasarinya. Proses yang sama mungkin berperan dalam perkembangan disfungsi paru kronis dalam konteks gejala sisa pascarawat ICU.4
Peradangan dan remodeling matriks merupakan proses yang terlibat dalam resolusi cedera paru akut. Namun, proses tersebut secara berulang-ulang dapat menjadi mekanisme patogenetik pada banyak penyakit paru-paru kronis. Persistensi respon inflamasi lokal telah dikaitkan dengan perkembangan fibrosis, karena pelepasan sitokin Th2 (IL-4, -5, -13) memiliki efek pro-fibrotik dan dapat merekrut fibrosit dari sirkulasi sistemik. Selain itu, mediator pro-inflamasi lainnya seperti IL1b atau IL-6 dapat mendorong deposisi kolagen yang dimediasi oleh IL-17.4
Dalam keadaan ini, makrofag alveolar, sel inflamasi dan fibroblas melepaskan molekul profibrotik selama cedera akut, seperti transforming growth factor-β (TGFβ), insulin-like growth factor (IGF-1), platelet derived growth factor (PDGF) atau connective tissue growth factor (CTGF). TGFβ mengaktifkan kompleks SMAD intraseluler melalui pengikatan dengan heterodimer serin/treonin kinase di permukaan sel. Kompleks SMAD yang teraktivasi memasuki nukleus dan bertindak sebagai faktor transkripsi yang mengatur berbagai proses seluler. Pada fibrosis, jalur ini meliputi deposisi matriks ekstraseluler dan pembelahan fibroblas serta diferensiasi menjadi miofibroblas. Sel-sel ini, ditandai dengan peningkatan kandungan intraseluler aktin otot polos α (α-SMA), memodifikasi komposisi matriks dengan meningkatkan pengendapan kolagen dan mengganggu elastin, sehingga menghasilkan lesi seperti bekas luka.4
Aktivasi koagulasi dan deposisi fibrin adalah mekanisme patogenetik lain yang diaktifkan selama cedera paru akut yang dikaitkan dengan komplikasi jangka panjang. Telah terbukti bahwa pasien dengan penyakit interstisial paru mengalami peningkatan ekspresi faktor prokoagulan di dalam paru, termasuk faktor jaringan atau trombin, atau penurunan protein C. Aktivasi reseptor teraktivasi proteinase (PAR) oleh proteinase dari kaskade koagulasi (trombin, tripsin, cathepsin, dll.) menyediakan hubungan mekanistik antara koagulasi dan fibrosis. Pensinyalan downstream setelah aktivasi PAR1 menghasilkan ekspresi beberapa faktor pertumbuhan profibrotik (CTFG, PDGF) dan selanjutnya memicu pelepasan lokal sitokin proinflamasi dan TGFβ.4
Transisi Epitel-Mesenkim (EMT) juga menjadi relevan dalam skenario ini, di mana terjadi remodeling jaringan secara besar-besaran. EMT adalah proses di mana sel epitel terpolarisasi memperoleh fenotip mesenkim, yang mencakup sintesis komponen matriks ekstraseluler. Selama EMT, sel epitel kehilangan sebagian karakteristik epitelnya, seperti ekspresi E-cadherin dan sitokeratin, dan memperoleh penanda mesenkim termasuk N-cadherin, vimentin, atau aktin otot polos α. Pada tingkat fisiologis, semua proses ini mendukung akumulasi jaringan fibrosa yang berlebihan, menurunkan kepatuhan paru-paru dan mengganggu dinamika dan difusi ventilasi. Model cedera paru-paru dan ventilasi mekanis in vivo telah menunjukkan aktivasi EMT, kemungkinan oleh sebuah mekanisme dependen Wnt, menunjukkan adanya hubungan antara proses mirip EMT dan perkembangan selanjutnya dari fibrosis paru.4
Gambaran umum lainnya pada kondisi kronis ini adalah disfungsi penghalang epitel, yang ditandai dengan perubahan komposisi sel epitel pernapasan pseudostratifikasi dengan hiperplasia dan metaplasia sel basal dan sel goblet. Selain itu, setelah kerusakan paru awal, disfungsi epitel yang menetap dikaitkan dengan fenotip sekretorik proinflamasi karena aktivasi sel epitel saluran napas, sel dendritik, dan Sel Limfoid bawaan tipe 2, dan pelepasan sitokin turunan epitel, termasuk limfopoietin stroma timus (TSLP), interleukin (IL)- 25, dan IL-33. Peradangan berkelanjutan dan perubahan komposisi seluler dapat memainkan peran penting dalam disfungsi paru pascarawat ICU.4
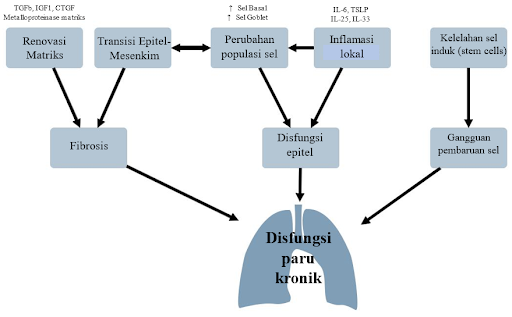
Dikutip dan dimodifikasi dari: Martin-Vicente P, López Martínez C, Lopez Alonso I, López Aguilar J, Albaiceta G, Amado Rodríguez L. Molecular mechanisms of postintensive care syndrome. Intensive Care Med Exp. 2021;9(58):1-17.
Terakhir, pembaruan sel adalah ciri utama penyakit paru-paru kronis. Aktivasi sel induk yang berlebihan menyebabkan akumulasi kerusakan DNA dan penuaan sel. Pada pasien dengan fibrosis paru idiopatik, sel epitel menunjukkan peningkatan ekspresi penanda penuaan, seperti P16 atau P21 dan fenotip proinflamasi. Aktivasi jalur ini dapat sebagai respons terhadap cedera paru akut. Banyaknya sel tua dikaitkan dengan kelelahan sel induk dalam hal kapasitas regeneratif dan peningkatan sekresi molekul inflamasi dan remodeling matriks, yang pada gilirannya dapat menyebabkan terjadinya fibrosis.4
Mekanisme molekuler gangguan kognitif
Ada beberapa mekanisme yang dapat menyebabkan cedera otak pada pasien sakit kritis. Sistem saraf pusat (SSP) menerima sinyal dari saraf dan faktor serta sel yang bersirkulasi. Mengenai yang pertama, saraf vagus merupakan jalur naik utama dari organ perifer. Sensor vagal distal responsif terhadap berbagai rangsangan, termasuk regangan (melalui saluran kation potensial reseptor sementara, subfamili V, anggota 4 [TRPV4] dan reseptor Piezo), atau peradangan (melalui toll-like receptor (TLR)-4, IL1R atau reseptor faktor nekrosis tumor [TNF] yang ada di neuron sensorik vagal). Ketika sinyal-sinyal ini mencapai batang otak, jalur multisinaptik di sepanjang SSP diaktifkan. Misalnya, peregangan paru mengaktifkan TRPV4 alveolar dan reseptor purinergik, yang, dengan cara yang bergantung pada vagus, meningkatkan sinyal dopaminergik dan memicu apoptosis hipokampus. Blokade reseptor pemicu di organ distal atau mediator sirkulasi dapat menurunkan risiko kerusakan jangka panjang. Pada model hewan, penghambatan mekanosensasi perifer dengan antagonis TRPV4, blokade konduksi saraf yang tidak spesifik dengan lidokain, atau penghambatan reseptor dopamin tipe 2 telah menurunkan apoptosis hipokampus.4
Molekul dan sel yang bersirkulasi juga dapat mencapai otak selama penyakit kritis. Respon inflamasi sistemik menurunkan permeabilitas sawar darah-otak dan memfasilitasi translokasi mediator sirkulasi dan/atau sel yang selanjutnya menyebabkan cedera otak. Fragmen heparan sulfat yang dilepaskan dari glikokalix endotel selama sepsis dapat bertranslokasi ke hipokampus dan menghambat sinyal faktor neurotropik yang diturunkan dari otak, yang mengakibatkan gangguan memori pada tikus. Sirkulasi IL-6 mungkin juga berperan dalam keadaan ini, karena blokade perifer IL-6 dengan antibodi monoklonal mencegah cedera otak akibat ventilator. Sejalan dengan temuan ini, pemberian lipopolisakarida intratrakeal meningkatkan ekspresi sitokin proinflamasi Il1b dan Il6 di batang otak. Menariknya, hanya peningkatannya saja Il1 bekspresi dihapuskan setelah vagotomi, menunjukkan aktivasi simultan dari mekanisme yang berbeda.4
Hubungan antara respons otak dan hasil fungsional juga telah dinilai. Pada model hewan besar yang menggunakan ventilasi mekanis pelindung jangka panjang, kerusakan hipokampus ditunjukkan. Kerusakan paru-paru akut dan ventilasi mekanis pada tikus menyebabkan peradangan otak, cedera hipokampus, dan gangguan memori, dengan cara yang dapat dicegah dengan steroid. Demikian pula, respon pengkondisian, penanda memori pengganti pada tikus, tidak ada 3 hari setelah ventilasi mekanis, namun tidak pada kontrol yang dianestesi dan tidak diberi ventilasi. Meskipun penerjemahan hasil eksperimen ini menjadi bukti klinis merupakan tantangan dan masih sulit dipahami, model cedera otak ini sebagai respons terhadap gangguan sistemik memberikan kerangka kerja untuk pencegahan, diagnosis, dan pengobatan disfungsi kognitif jangka panjang pada pasien sakit kritis.4
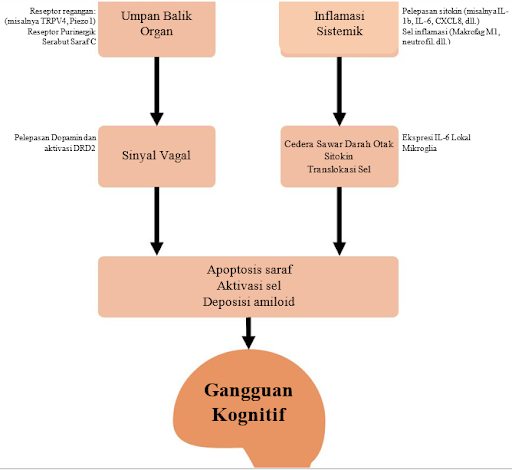
Dikutip dan dimodifikasi dari: Martin-Vicente P, López Martínez C, Lopez Alonso I, López Aguilar J, Albaiceta G, Amado Rodríguez L. Molecular mechanisms of postintensive care syndrome. Intensive Care Med Exp. 2021;9(58):1-17.
Mekanisme ICU Acquired-Weakness (ICU-AW)
ICU-AW adalah keterlibatan neuromuskular bilateral dan simetris, umum terjadi pada pasien sakit kritis yang menggunakan ventilasi mekanis. Studi klinis di rangkaian perawatan kritis yang melibatkan tes elektrofisiologi dan histopatologi otot menunjukkan bahwa polineuropati dan miopati dapat terjadi bersamaan pada pasien ICU, sedangkan miopati lebih sering diidentifikasi sebagai penyebab kelemahan. Neuropati penyakit kritis digambarkan sebagai polineuropati sensorik-motorik aksonal distal yang mempengaruhi otot tungkai dan pernapasan. Beberapa bukti menunjukkan bahwa pemulihan kelemahan dapat memburuk dan/ atau tertunda ketika neuropati menyertai miopati, yaitu kecacatan yang menetap terkait dengan polineuropati dan miopati yang hidup berdampingan. Karena studi konduksi saraf dan elektromiografi jarum tidak secara akurat membedakan kedua entitas tersebut, dan mengingat masalah klinis yang cukup relevan yaitu kelemahan otot pada pasien ini, istilah ICU-AW muncul terlepas dari sifat penyebabnya. Meskipun kecacatan fisik yang berhubungan dengan ICU-AW sangat umum terjadi pada pasien yang selamat dari ICU, spektrum klinisnya bervariasi tidak hanya dalam tingkat keparahan tetapi juga dalam jangka waktu pemulihan. Atrofi otot pada pasien yang sakit kritis telah dibuktikan dimulai dalam beberapa jam pertama setelah masuk ICU pada pasien yang menggunakan ventilasi mekanis dan perkembangannya dikaitkan dengan beberapa faktor, seperti peradangan sistemik, tingkat keparahan penyakit yang mendasari, penggunaan penghambat neuromuskular atau ventilasi mekanis itu sendiri.4
Berbagai mekanisme molekuler, baik independen atau berinteraksi, terlibat dalam pengecilan otot dan berkembang seiring berjalannya waktu, mulai dari timbulnya penyakit kritis hingga fase pemulihan jangka panjang sekitar 6 bulan setelah keluar dari ICU. Kehilangan massa otot disebabkan oleh peningkatan proteolisis yang dipicu pada fase akut, sehingga melebihi kapasitas regeneratif jaringan yang terluka. Namun, aktivasi awal jalur proteolitik tidak bertahan lama, melainkan dapat mengubah biologi otot yang mengakibatkan gangguan pertumbuhan kembali otot.4
Sitokin inflamasi diduga memainkan peran yang relevan dalam perkembangan ICU-AW. TNFα telah dipelajari secara luas dalam kondisi ini. Dalam myotube yang berdiferensiasi, TNFα merangsang katabolisme dengan mengikat reseptor TNF subtipe 1 dan mengaktifkan faktor nuklir-kB. Faktor transkripsional ini penting untuk pengurangan protein otot yang diinduksi TNFα dan hilangnya kandungan rantai berat miosin dewasa, yang secara khusus ditemukan pada pasien sakit kritis. Jalur ini juga sensitif terhadap spesies oksigen reaktif, yang tampaknya berfungsi sebagai pembawa pesan kedua untuk TNFα di otot rangka. Pensinyalan TNFα/faktor nuklir-kB juga terlibat dalam proses diferensiasi, mewakili mekanisme yang bertanggung jawab atas aktivasi sel satelit dan pemulihan otot skeletal setelah fase akut. Pengikatan TNFα pada reseptornya juga menstimulasi apoptosis dan kinase terminal Jun-N serta protein kinase teraktivasi mitogen (MAPKs) dalam myotube yang berdiferensiasi. Dalam sel otot, peristiwa pensinyalan ini menstimulasi ekspresi gen yang berhubungan dengan jalur ubiquitin-proteasome, memicu proteolisis intraseluler besar-besaran. Terakhir, TNFα juga diketahui mempengaruhi kekuatan kontraksi otot bahkan tanpa adanya atrofi melalui TNFR1 dan dimediasi oleh peningkatan aktivitas oksidan sitosol.4
Peningkatan kadar IL-1 umumnya ditemukan pada serum pasien sakit kritis dan merupakan stimulus potensial terhadap hilangnya protein dan atrofi otot. Mekanisme mendasar yang disarankan terkait dengan sintesis dan degradasi protein. Menariknya, IL-6 telah terbukti mendorong sindrom respon anti-inflamasi kompensasi sistemik, dengan menghambat pelepasan TNFα dan menstimulasi IL-10. Pada otot rangka, IL-6 terlibat dalam miogenesis, metabolisme lipid, pengambilan glukosa, serta sintesis dan degradasi protein. Sel otot rangka telah dikenal sebagai organ sekretor miokin dan bahkan pengatur potensial sistem imun. Pada pasien dengan ventilasi mekanis yang mengalami miopati, respon fase akut yang dipicu oleh peradangan mengakibatkan peningkatan produksi IL-6 pada otot rangka.4
Analisis histologis dan molekuler yang dilakukan pada biopsi otot rangka pasien sakit kritis menunjukkan bahwa kegagalan pemulihan mungkin berhubungan dengan hilangnya sel satelit/progenitor dan fibrosis, namun tidak jelas mekanisme apa yang mendasari terjadinya penipisan sel satelit atau apa peran ceruk sel otot rangka secara keseluruhan. Dalam skenario lain, di mana cedera otot dapat terjadi, perbaikan jaringan otot merupakan proses biologis kompleks yang melibatkan aktivasi sel induk. Sel induk miogenik, yang disebut sel satelit, berada di bawah lamina basal serat otot. dan mengekspresikan NCAM/CD56 dan penanda sel miogenik awal, seperti M-cadherin, PAX7, dan MYF5. Sel satelit tetap diam di otot rangka, namun mereka dapat berproliferasi dan berdiferensiasi lebih lanjut menjadi mioblas sebagai respons terhadap sinyal pengaktifan, sehingga dapat terjadi regenerasi otot. Sel satelit yang teraktivasi dapat berinteraksi dengan makrofag yang direkrut di tempat regenerasi otot dan menerima sinyal mitogenik dari sel imun ini, yang dimediasi oleh pelepasan berbagai faktor terlarut. Mioblas, dan pada tingkat yang lebih tinggi, myotube, juga menerima sinyal pro-survival yang dimediasi oleh kontak sel dari makrofag.4
Demikian pula, mikrovaskuler tampaknya menjadi mitra sel satelit lainnya. Sel-sel satelit yang diam mudah berinteraksi dengan sel-sel endotel pada saat aktivasi untuk mengatur angio-miogenesis terkoordinasi secara fungsional. Memang benar, angiogenesis dan miogenesis dapat berbagi faktor regulasi seperti faktor pertumbuhan endotel vaskular (VEGF) atau faktor pertumbuhan seperti insulin tipe 1 (IGF1) yang secara timbal balik menandakan kedua proses yang sangat terlibat dalam regenerasi otot.4
Selain peradangan dan penipisan sel induk, beberapa mekanisme lain mungkin terlibat dalam perkembangan kelemahan otot yang terus-menerus pada penyintas penyakit kritis. Kerusakan/ disfungsi sensorik-motorik aksonal distal juga telah dijelaskan di ICU-AW, yang disebabkan oleh berkurangnya rangsangan membran akibat depolarisasi membran dan disfungsi saluran ion, bersama dengan perubahan homeostatis kalsium. Pada pasien sakit kritis yang menunjukkan polineuropati, akson motorik juga terdepolarisasi. Depolarisasi membran kronis dapat berhubungan dengan hipoperfusi jaringan atau peningkatan kalium ekstraseluler pada pasien dengan gagal ginjal, dan dapat menyebabkan atrofi otot. Berkurangnya potensial aksi motorik gabungan terdapat pada neuropati dan miopati. Selain itu, telah dijelaskan potensi fibrilasi atau gelombang tajam positif yang dapat dijelaskan oleh denervasi atau disfungsi saluran natrium otot. Disfungsi mitokondria bisa menjadi penyebab cacat yang terlibat dalam proses yang bergantung pada energi, dan disregulasi dalam autophagy juga telah digambarkan berperan dalam perbaikan otot.4
Selain peradangan dan penipisan sel induk, beberapa mekanisme lain mungkin terlibat dalam perkembangan kelemahan otot yang terus-menerus pada penyintas penyakit kritis. Kerusakan/ disfungsi sensorik-motorik aksonal distal juga telah dijelaskan di ICU-AW, yang disebabkan oleh berkurangnya rangsangan membran akibat depolarisasi membran dan disfungsi saluran ion, bersama dengan perubahan homeostatis kalsium. Pada pasien sakit kritis yang menunjukkan polineuropati, akson motorik juga terdepolarisasi. Depolarisasi membran kronis dapat berhubungan dengan hipoperfusi jaringan atau peningkatan kalium ekstraseluler pada pasien dengan gagal ginjal, dan dapat menyebabkan atrofi otot. Berkurangnya potensial aksi motorik gabungan terdapat pada neuropati dan miopati. Selain itu, telah dijelaskan potensi fibrilasi atau gelombang tajam positif yang dapat dijelaskan oleh denervasi atau disfungsi saluran natrium otot. Disfungsi mitokondria bisa menjadi penyebab cacat yang terlibat dalam proses yang bergantung pada energi, dan disregulasi dalam autophagy juga telah digambarkan berperan dalam perbaikan otot.4
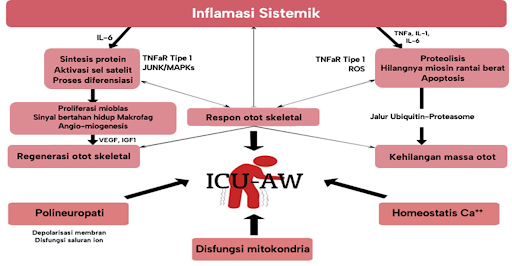
Dikutip dan dimodifikasi dari: Martin-Vicente P, López Martínez C, Lopez Alonso I, López Aguilar J, Albaiceta G, Amado Rodríguez L. Molecular mechanisms of postintensive care syndrome. Intensive Care Med Exp. 2021;9(58):1-17.
Pada pasien yang sakit kritis, ukuran sampel yang terbatas dari spesimen otot menghalangi identifikasi subfenotip kelemahan otot dengan mekanisme spesifik yang berbeda, dengan temuan histopatologis yang berbeda dan didorong oleh mekanisme yang berbeda, meskipun mengarah pada spektrum klinis yang luas dari kecacatan fungsional jangka panjang. Subfenotip patogenetik yang berbeda ini dapat menjelaskan kesembuhan heterogen yang diamati di antara para penyintas penyakit kritis. Misalnya, jalur yang diaktifkan dapat mendorong proliferasi sel satelit pada beberapa pasien, sementara pada pasien lain terkait dengan perbaikan fibrotik dan penipisan sel satelit. Memahami mekanisme ini sangat penting untuk mengidentifikasi target terapi yang, jika diintervensi pada awal proses, dapat mengubah perjalanan klinis ICU-AW sebelum masa stabil 6 bulan tercapai.4
Gejala Klinis Sindrom Pascarawat Intensif
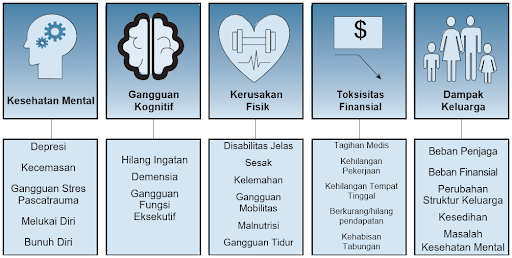
Sindrom Pascarawat Intensif dapat mencakup gangguan kognitif, kesehatan mental, fungsi fisik, atau kombinasinya setelah pulih dari penyakit kritis. Hubungan yang kompleks dapat terjadi di antara domain-domain ini, dengan defisit di satu bidang sering kali memengaruhi dan berdampingan dengan defisit di bidang lainnya. Insiden, manifestasi klinis, dan faktor risiko gangguan pada setiap ranah dibahas di sini.1,8
Domain Kognitif
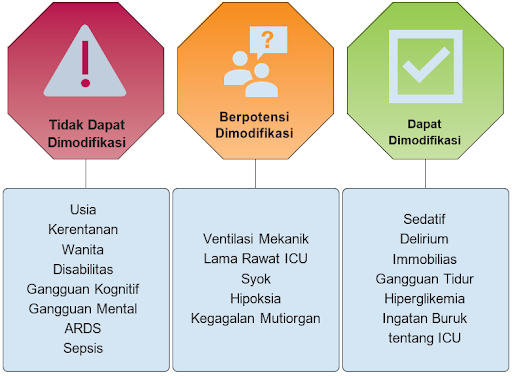
Gangguan kognitif terjadi pada sekitar 40% pasien yang selamat di ICU pada 3-6 bulan setelah penyakit kritis dan bertahan setidaknya selama 1 tahun pada beberapa pasien. Area yang paling terpengaruh adalah perhatian/konsentrasi, memori, kecepatan pemrosesan mental, dan fungsi eksekutif. Diantaranya, memori dan fungsi eksekutif adalah domain yang paling sering terkena dampaknya. Faktor risiko tinggi terjadinya gangguan kognitif dapat diidentifikasi dalam dua periode: sebelum dan selama sakit kritis. Faktor risiko ini adalah disfungsi kognitif yang sudah ada sebelumnya, delirium, sepsis, syok, hipoksia, ventilasi mekanis invasif, dan sindrom gangguan pernapasan akut (ARDS).7
Pasien yang selamat dari penyakit kritis rentan terhadap disfungsi kognitif terlepas dari komorbiditas, usia, dan kondisi yang sudah ada sebelumnya. Defisit kognitif dapat bersifat menetap, dengan sepertiga pasien yang bertahan di ICU menunjukkan defisit sampai dengan satu tahun setelah rawat inap. Hal ini serupa dengan tingkat gangguan yang tampak pada cedera otak traumatis sedang dan demensia Alzheimer.1,9
B:
Dikutip dan dimodifikasi dari: Schwitzer E, Jensen K, Brinkman L, et al. Survival recovery: a narrative review of post-intensive care syndrome. Chest. 2023;1(1):1-14.
Manifestasi klinis dapat mencakup penurunan daya ingat, fungsi eksekutif, kecepatan pemrosesan mental, perhatian, atau konsentrasi, yang semuanya secara kolektif dapat menghalangi seseorang untuk terlibat dalam perilaku yang diperlukan untuk melakukan aktivitas kehidupan sehari-hari dan kembali ke status fungsional sebelum mengalami sakit kritis.1,10
Disfungsi kognitif setelah dirawat di ICU dikaitkan dengan penurunan kualitas hidup yang berhubungan dengan kesehatan (HRQoL), kembali bekerja, dan kemandirian. Disfungsi kognitif dapat terjadi bahkan pada individu yang sebelumnya sehat, terlebih pada pasien Geriatrik dengan gangguan kognitif yang sudah ada sebelumnya. Begitu pula pada pasien yang mengalami syok, hipoksia, rawat inap di ICU dalam waktu lama, atau membutuhkan sedasi atau ventilasi mekanis.1,11
Di antara faktor risiko potensial yang dapat dimodifikasi, delirium adalah yang dipelajari paling ekstensif. Bahkan setelah disesuaikan dengan usia, pendidikan, fungsi kognitif yang sudah ada sebelumnya, tingkat keparahan penyakit, dan paparan dengan obat sedatif, durasi delirium merupakan prediktor independen dari gangguan kognitif jangka panjang.1,12
Kerja sama dengan ahli terapi okupasi dan fisik untuk melakukan mobilisasi dini secara aman dapat mengurangi risiko gangguan kognitif lebih lanjut.13
Domain Psikologis
Masalah kesehatan mental terjadi pada sekitar 10-40% pasien yang selamat di ICU pada 3-12 bulan setelah penyakit kritis. Masalah kesehatan mental termasuk kecemasan, depresi, dan gangguan stres pasca-trauma (PTSD). Prevalensi gejala kecemasan dan depresi masing-masing sebesar 34% dan 29% pada 12-14 bulan setelah perawatan intensif. Prevalensi PTSD lebih jarang dibandingkan kecemasan dan depresi, dan prevalensinya sebesar 19% dalam 12 bulan. Dalam sebuah penelitian di Inggris, 40% mengalami depresi, dan 79% di antaranya juga mengalami gejala kecemasan. Yang mengejutkan, 18% dari seluruh pasien mengalami tiga gejala. Masalah kesehatan mental ini berdampak negatif pada kualitas hidup pasien yang berhubungan dengan kesehatan. Faktor risiko masalah kesehatan mental adalah masalah kesehatan mental sebelum masuk ICU dan pengalaman stres selama dirawat di ICU.7
Morbiditas psikiatris setelah penyakit kritis adalah hal yang umum terjadi. Kecemasan, depresi, dan gangguan stres pascatrauma (PTSD) dilaporkan pada 62%, 36%, dan 39% pasien, dengan tingkat kesamaan gejala yang tinggi di antara ketiga kondisi ini. Pasien yang selamat dari ICU juga memiliki risiko yang lebih tinggi untuk melakukan perilaku bunuh diri dan melukai diri sendiri dibandingkan dengan pasien yang tidak memerlukan perawatan di ICU. Selain itu, gangguan tidur sering terjadi setelah dirawat di ICU, terjadi pada hingga 57% pasien 6 bulan setelah keluar dari rumah sakit, dan sering dikaitkan dengan gangguan psikologis yang sedang berlangsung.1,14
Gejalanya dapat berupa insomnia awal atau insomnia pemeliharaan, tidur yang tidak memulihkan, kelelahan, dan mimpi buruk. Insomnia kronis dapat memperburuk depresi, kecemasan, dan nyeri kronis, yang semuanya dapat memperburuk irama sirkadian, yang kemudian mengakibatkan siklus yang terus berlanjut. Meskipun beberapa masalah ini dapat bersifat situasional, masalah tidur dan kesehatan mental dapat berlangsung selama berbulan-bulan hingga bertahun-tahun dan dapat menyebabkan kecacatan serta penurunan kualitas hidup pasien dan keluarga.1,10
Faktor risiko gejala sisa psikologis meliputi usia muda, diagnosis kesehatan mental sebelumnya, dan kebutuhan ventilasi mekanis. Gangguan tidur yang sudah ada sebelumnya dan gangguan tidur di rumah sakit dikaitkan dengan risiko yang lebih besar terhadap gangguan tidur pascamorbid.1,15
Domain Fisik
Gangguan fisik berkepanjangan terjadi pada sekitar 30% pasien yang selamat di ICU 3-6 bulan setelah penyakit kritis. Hasil tes berjalan selama 6 menit memburuk di bawah tingkat normal pada jarak rata-rata 361 m pada 3 bulan dan pada 411 m pada 60 bulan setelah keluar dari rumah sakit. Gangguan fisik ini sering menyebabkan ketidakmampuan persisten dalam aktivitas hidup sehari-hari (ADL), dan 33% pasien mengalami ketergantungan parsial pada setidaknya satu bagian ADL dalam 12 bulan setelah penyakit kritis. Salah satu faktor risiko gangguan fisik berkepanjangan adalah komplikasi neuromuskular yang didapat selama dirawat di ICU, yang disebut kelemahan yang didapat di ICU (ICU-AW). ICU-AW diamati pada sekitar 30-50% pasien sakit kritis. Komplikasi neuromuskular ini mempengaruhi kekuatan pegangan tangan, kinerja tes jalan 6 menit, SF-36, dan kematian bahkan 5 tahun setelah keluar dari rumah sakit.7
Sebanyak 80% pasien yang selamat dari ICU mengalami disfungsi fisik yang baru setelah pasien tersebut keluar dari ICU. Jenis gangguan fisik bervariasi dan dapat mencakup kelemahan yang didapat di ICU (ICU-AW), gangguan fungsi paru, dan cachexia. Selama pada minggu pertama penyakit kritis, pasien kehilangan sekitar 2% massa otot per hari, membuat mereka menjadi lemah secara terus-menerus. ICU-AW, yang didefinisikan sebagai disfungsi neuromuskuler tanpa penyebab selain penyakit kritis dan perawatannya, sering kali merupakan akibat dari miopati penyakit kritis, polineuropati penyakit kritis, ataupun kombinasi keduanya. Kelompok gangguan ini terjadi pada hampir separuh dari pasien yang bertahan hidup di ICU dan dapat bermanifestasi dalam berbagai cara, termasuk mobilitas yang buruk, kelemahan, kontraktur, dan berkurangnya toleransi untuk berolahraga.1,16
Miopati penyakit kritis biasanya membaik dalam hitungan minggu hingga beberapa bulan, tetapi polineuropati penyakit kritis dapat bertahan selama bertahun-tahun setelah kemunculan awal.17 Secara fungsional, masalah ini dapat mengakibatkan berkurangnya kemampuan untuk berpartisipasi dalam aktivitas kehidupan sehari-hari, menurunkan HRQoL, dan kecacatan.18 Faktor risiko terjadinya ICU-AW antara lain, sepsis, kegagalan multiorgan, hiperglikemia, perempuan, Geriatrik (> 60 tahun), kelemahan (skor Skala Kelemahan Klinis > 4), dan ventilasi mekanis yang berkepanjangan. Di antara faktor risiko yang dapat dimodifikasi, penggunaan blokade neuromuskuler dan kortikosteroid secara historis telah terlibat dalam pengembangan miopati penyakit kritis, terutama ketika dikombinasikan. Namun, data sebelumnya menunjukkan bahwa penggunaan jangka pendek obat-obatan tersebut bisa saja aman. Selain itu, mobilisasi pasien (misalnya, mobilisasi progresif yang dimulai dengan rentang gerak dan akhirnya berlanjut ke aktivitas mobilitas di luar tempat tidur) merupakan tindakan pencegahan yang diketahui dapat mengurangi risiko ICU-AW.1
Pasien dengan ARDS mungkin memiliki gejala berkelanjutan yang spesifik terhadap intubasi mekanis (misalnya, stenosis trakea, disfungsi pita suara, atau kerusakan gigi). Hasil fungsi paru mungkin bervariasi, tetapi sebagian besar pasien tanpa fungsi paru yang sudah ada sebelumnya akan mendapatkan kembali fungsi paru yang mendekati normal dengan defisit kapasitas difusi yang menetap tetapi ringan, meskipun beberapa mungkin mengalami sesak napas dan batuk yang berkelanjutan. Selain itu, beberapa orang yang selamat mungkin mengalami fibrosis paru pasca-ARDS, meskipun frekuensi komplikasi ini tidak jelas.1
Disabilitas, Penggunaan Layanan Kesehatan, dan Mortalitas
Gejala sisa kolektif dari penyakit kritis pada akhirnya dapat menyebabkan kelemahan, kecacatan, dan penurunan HRQoL. Kelemahan baru atau memburuknya kelemahan diamati pada 40% pasien yang bertahan hidup di ICU satu tahun setelah keluar dari rumah sakit. Dengan demikian, setidaknya disabilitas parsial terlihat pada 20% individu yang sebelumnya mandiri 1 tahun setelah keluar dari rumah sakit, dengan skor rendah yang sebagian besar disebabkan oleh penurunan fungsi fisik. Dapat diprediksi, HRQoL juga berkurang secara signifikan jika dibandingkan dengan peserta kontrol yang sesuai dengan usia dan jenis kelamin. Hal ini paling terlihat pada pasien dengan penyakit yang sudah ada sebelumnya, serta pasien dengan ARDS, ventilasi mekanis yang berkepanjangan, sepsis berat, trauma, atau keganasan.1
Pola penggunaan layanan kesehatan juga dapat berubah setelah penyakit kritis, dengan peningkatan risiko rawat inap ulang yang dapat berlangsung selama bertahun-tahun. Lebih dari separuh pasien dirawat kembali setelah keluar dari rumah sakit, dan pada tahun setelah penyakit kritis, para penyintas menunjukkan peningkatan kunjungan rawat jalan, kunjungan UGD, dan rawat inap dibandingkan dengan tahun sebelumnya. Rawat inap di rumah sakit untuk pasien yang selamat dari ICU juga 51% lebih mahal dibandingkan dengan peserta kontrol yang usianya sebaya. Secara keseluruhan, hal ini berarti penggunaan sumber daya dan biaya yang jauh lebih tinggi bagi sistem perawatan kesehatan.1
Akhirnya, risiko kematian tetap tinggi bahkan setelah pasien selamat dari penyakit kritis, dengan tingkat kematian 1 tahun hingga 21%. Risiko ini terutama terlihat pada pasien yang selamat dari ICU yang menerima ventilasi mekanis, yang angka kematiannya dalam 1 tahun dapat melebihi 40%.1
Sindrom Pascarawat Intensif pada Pediatri (PICS-p)
Sindrom Pascarawat Intensif pada Pediatri (PICS-p) menggambarkan bagaimana morbiditas baru atau yang memburuk pada penyintas PICU dapat digambarkan melalui domain kesehatan fisik, kognitif, emosional, dan sosial. PICS-p menyadari bahwa status kesehatan anak yang sudah ada sebelumnya, penatalaksanaan penyakit kritis akutnya, serta tahap kedewasaan dan pertumbuhannya, dapat mempengaruhi tingkat keparahan dan luasnya gangguan yang didapat di luar PICU. Lebih jauh lagi, kerangka kerja ini mengakui bahwa penyintas PICU adalah bagian dari unit keluarga, dimana anggota keluarga seperti pengasuh dan saudara kandung juga mungkin terkena dampaknya. Misalnya, baik anak-anak maupun pengasuhnya mungkin mengalami respons psikologis seperti stres pasca-trauma (PTS) dan beban psikologis seperti itu dapat berkontribusi pada pemulihan sosial dan emosional.19
Dalam ranah fisik, akibat dari penyakit kritis dapat bersifat spesifik pada organ tertentu, atau lebih umum, termasuk disfungsi pernapasan, nyeri kronis, epilepsi, gangguan tidur, kelelahan, kelemahan otot yang parah, berkurangnya perawatan diri, dan gangguan makan. Hasil yang merugikan secara fisik mungkin disebabkan oleh penyakit yang mendasarinya (misalnya: gangguan pendengaran setelah meningitis), karena perawatan PICU (misalnya: stenosis subglotis setelah intubasi endotrakeal) atau karena kombinasi keduanya. Jelasnya, cedera otak dan kondisi neurologis dapat memengaruhi fungsi kognitif serta perkembangan sosial dan emosional anak. Jalur pemulihan fisik, kognitif, emosional, dan sosial, yang berjalan secara bersamaan, dimulai saat keluar dari PICU, dan berakhir pada pencapaian 'normal baru', tercakup dalam konsep kualitas hidup yang berhubungan dengan kesehatan (kualitas hidup). Sebuah tinjauan terhadap kualitas hidup setelah masuk ke PICU, menyimpulkan bahwa skor yang lebih buruk berhubungan dengan kondisi yang sudah ada sebelumnya, intervensi dan kejadian di PICU (misalnya: ECMO atau serangan jantung), faktor sosial dan lingkungan, dan kesehatan mental orang tua.19
Akhirnya, risiko kematian tetap tinggi bahkan setelah pasien selamat dari penyakit kritis, dengan tingkat kematian 1 tahun hingga 21%. Risiko ini terutama terlihat pada pasien yang selamat dari ICU yang menerima ventilasi mekanis, yang angka kematiannya dalam 1 tahun dapat melebihi 40%.1
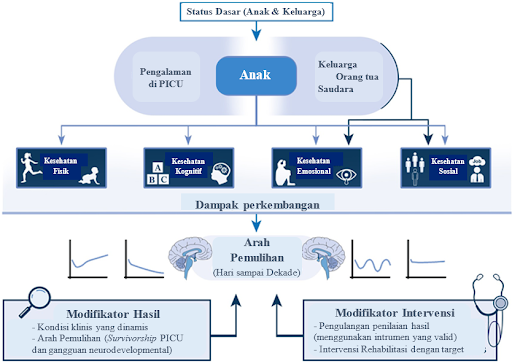
Dikutip dan dimodifikasi dari: Brown K, Agrawal S, Kirschen M, et al. The brain in pediatric critical care: unique aspects of assessment, monitoring, investigations, and follow up. Intensive Care Med. 2022;48(5):535-47.
Sindrom Pascarawat Intensif pada Geriatrik
Meskipun tingkat kelangsungan hidup pada pasien dengan penyakit kritis dan membutuhkan perawatan ICU meningkat, pasien yang selamat dapat mengalami gangguan jangka panjang dalam satu atau lebih domain kognitif, psikiatri, dan fisik. Kelompok gangguan ini dikenal sebagai PICS. Diagnosis ini tidak termasuk pasien yang mengalami cedera otak traumatis atau stroke. Efek melemahkan yang serupa pada anggota keluarga, khususnya gejala psikologis di antara mereka yang merawat pasien di ICU dan setelah keluar dari ICU, disebut sebagai sindrom pascarawat intensif di keluarga (PICS-F).20
Penting untuk menyadari kondisi ini pada pasien yang lebih tua. Jumlah pasien usia lanjut dengan penyakit kritis meningkat seiring dengan peningkatan populasi yang menua. Dibandingkan dengan populasi pasien lainnya, pasien yang lebih tua lebih banyak dirawat di ICU dan memiliki risiko tinggi mengigau, yang merupakan faktor risiko terjadinya disfungsi kognitif pada PICS.20
Sekitar 50%-70% dari semua pasien yang selamat dari ICU memiliki setidaknya satu gangguan terkait PICS, yang dapat bertahan hingga 15 tahun setelah keluar dari ICU. Sebuah penelitian terhadap penerima manfaat Medicare (usia rata-rata 76,9 tahun) menemukan bahwa 60% dari 1.520 pasien rawat inap di ICU yang mengalami sepsis berat berhubungan dengan memburuknya fungsi kognitif atau fisik 1 tahun setelah rawat inap, dan 16,7% pasien yang selamat menunjukkan gangguan kognitif sedang hingga berat. Sebuah studi kohort retrospektif terhadap 21.520 pasien Medicare mengungkapkan bahwa rawat inap di ICU selama 3 hari atau lebih, tingkat keparahan sepsis, usia yang lebih tua, kelemahan, depresi, dan demensia meningkatkan kemungkinan kecacatan fisik pada orang dewasa yang lebih tua yang menerima perawatan di rumah. Studi lain melaporkan bahwa 15% pasien yang lebih tua yang selamat dari ICU memiliki diagnosis baru demensia 3 tahun setelah dirawat di ICU, dengan hampir 40% kasus demensia baru didiagnosis pada tahun pertama setelah dirawat di ICU.20,21
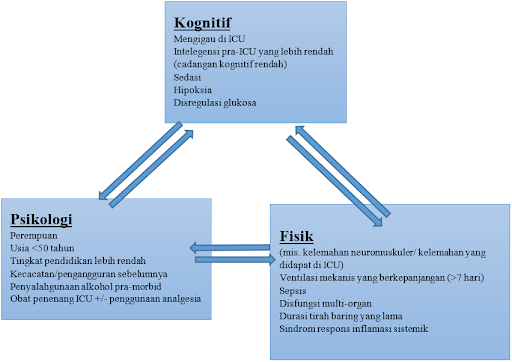
Dikutip dan dimodifikasi dari: Ahmad M, Teo S. Post-intensive Care Syndrome. Ann Geriatr Med Res. 2021;25(2):75-8.
Faktor risiko utama untuk PICS kognitif termasuk delirium, cadangan kognitif yang buruk, sepsis, dan sindrom gangguan pernapasan akut. Durasi delirium dilaporkan sebagai faktor risiko independen untuk gangguan kognitif pada 6 dan 12 bulan. Namun, tidak ada bukti kuat yang menunjukkan bahwa geriatrik berisiko lebih tinggi untuk mengalami PICS kognitif daripada orang dewasa yang lebih muda.20,21
Sebuah studi prospektif terhadap 821 pasien ICU menunjukkan skor fungsi kognitif dan eksekutif yang serupa antara pasien berusia 65 tahun ke atas dan pasien yang lebih muda pada 3 dan 12 bulan setelah keluar dari ICU. Pasien dengan tingkat pendidikan yang lebih tinggi, yang merupakan indikator dari cadangan kognitif, memiliki risiko yang lebih rendah untuk mengalami komplikasi ini pada 3 dan 12 bulan.20
Sekitar 50% pasien yang selamat dari ICU yang lebih tua menunjukkan pemulihan fungsional setelah penyakit kritis, dengan waktu pemulihan rata-rata 3 bulan. Pasien yang selamat dari sepsis berat mengalami 1,5 keterbatasan baru dalam aktivitas sehari-hari (ADL), dibandingkan dengan 0,5 pada pasien yang tidak dirawat di ICU. Pasien yang selamat dari sepsis berat yang menggunakan ventilator mekanik memiliki kemungkinan 30% lebih besar untuk mengalami disabilitas ADL. Gangguan fisik mengakibatkan kebutuhan akan dukungan yang lebih besar setelah keluar dari rumah sakit.20,21
Kecacatan fungsional yang sudah ada sebelumnya, gangguan kognitif, dan kelemahan sangat terkait dengan PICS fisik atau kelemahan yang didapat di ICU (ICU-AW). Ventilasi mekanis yang berkepanjangan (>7 hari), imobilitas, sindrom respons inflamasi yang sedang berlangsung akibat sepsis, dan disfungsi multi-organ juga dikaitkan dengan perkembangan ICU-AW. Patofisiologi dari kondisi ini adalah sebagai berikut: iskemia mikrovaskuler, katabolisme, dan imobilitas yang berkepanjangan menyebabkan penyusutan otot rangka, sedangkan cedera mikrovaskuler menyebabkan iskemia saraf, disfungsi saluran natrium yang berhubungan dengan saraf, dan cedera mitokondria. Hal ini menyebabkan neuropati, miopati, atau keduanya yang berhubungan dengan penyakit kritis.20
Pasien yang mengalami penyakit kritis memiliki insiden penyakit psikologis premorbid yang lebih tinggi dibandingkan dengan pasien yang tidak memerlukan rawat inap di ICU dan populasi umum. Sementara pasien yang selamat dari ICU memiliki tingkat komorbiditas psikologis yang lebih tinggi 4 hingga 6 kali lipat dibandingkan dengan populasi umum, pasien yang mengalami PICS psikologis cenderung memiliki gangguan psikologis yang sudah ada sebelumnya. Depresi, kecemasan, dan gangguan stres pascatrauma (PTSD) adalah tiga manifestasi umum dari PICS psikologis, yang masing-masing terjadi pada 19%-37%, 32%-40%, dan 19%-22% pasien.20,21
Sindrom Pascarawat Intensif di Keluarga (PICS-F)
Penyakit kritis dapat berdampak besar pada kualitas hidup keluarga pasien. Seorang anggota keluarga mengalami kecemasan, depresi, dan PTSD selama tinggal di ICU dan beberapa bulan setelah keluar dari rumah sakit. Kondisi ini disebut PICS-F (keluarga). PICS-F diamati pada 48% anggota keluarga sekitar 90 hari setelah dirawat di ICU dengan 13% depresi, 29% kecemasan, dan 39% PTSD. Penyebab PICS-F diklasifikasikan menjadi faktor terkait penyakit kritis, terkait ICU, dan terkait sistem layanan kesehatan. Setelah penyakit kritis, keluarga mengalami gejala sisa psikologis yang negatif karena perubahan emosional, seperti kesedihan yang disebabkan melihat pasien sakit kritis, kemarahan terhadap penyakit, dan ketakutan kehilangan pasien. Dalam kondisi seperti ini, peran pengambilan keputusan menimbulkan tekanan psikologis yang berat, terutama mengenai keputusan akhir hayat. Lebih jauh lagi, stres ini memburuk setelah kematian pasien. Sebaliknya, faktor yang berhubungan dengan ICU meliputi informasi yang tidak memadai, komunikasi yang buruk dengan staf, dan pembatasan kunjungan. Faktor yang berhubungan dengan sistem layanan kesehatan termasuk beban keuangan untuk merawat pasien, yang dialami oleh 48,5% keluarga 3 bulan setelah keluar dari ICU.7
Dampak dari bertahan hidup di ICU tidak hanya mempengaruhi pasien itu sendiri. Sekitar 25% dan 50% pasien yang selamat dari ICU memerlukan dukungan perawatan keluarga jangka panjang yang dapat menyerupai beban pengasuhan yang terlihat pada penyakit kronis lainnya. Pada gilirannya, para pengasuh dapat mengalami gejala psikologis baru, yang secara kolektif disebut sebagai Sindrom Pascarawat Intensif di keluarga. Prevalensinya sangat bervariasi, mulai dari 6% hingga 69% dalam 6 bulan pertama dan berpotensi berlangsung selama bertahun-tahun. Gangguan yang paling umum terjadi adalah kecemasan (73%), depresi (50%), kesedihan yang rumit (52%), dan PTSD (56%). Gejala-gejala ini biasanya berkurang seiring berjalannya waktu, tetapi dapat bertahan pada sekitar sepertiga orang pada 6 bulan, dengan HRQoL yang rendah dan tekanan psikologis yang dilaporkan selama bertahun-tahun setelahnya.1
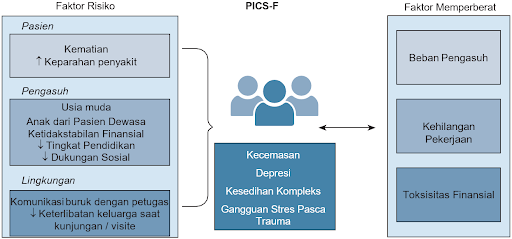
Dikutip dan dimodifikasi dari: Schwitzer E, Jensen K, Brinkman L, et al. Survival Recovery: A Narrative Review of Post-Intensive Care Syndrome. Chest. 2023;1(1):1-14.
Faktor-faktor risiko untuk terjadinya Sindrom Pascarawat Intensif di keluarga secara luas dapat dikategorikan ke dalam karakteristik yang terkait dengan pasien, pengasuh, dan lingkungan. Khususnya, banyak faktor risiko lingkungan untuk Sindrom Pascarawat Intensif di keluarga yang dapat dimodifikasi, termasuk komunikasi yang buruk antara staf dan keluarga dan kurangnya kehadiran keluarga pada saat rawat gabung. Hal ini disoroti selama pandemi COVID-19, ketika pembatasan yang signifikan diberlakukan pada kunjungan keluarga. Tingkat PTSD yang dilaporkan pada anggota keluarga meningkat dua kali lipat dari tingkat sebelum pandemi. Intervensi lain yang dapat meningkatkan risiko Sindrom Pascarawat Intensif di Keluarga termasuk pertemuan keluarga yang dipimpin oleh dokter perawatan paliatif eksternal tanpa partisipasi tim utama, serta mengirimkan surat duka cita kepada keluarga setelah kematian pasien. Hal yang pertama dianggap sebagai hasil dari ketidaksesuaian dalam komunikasi antara staf, dan yang kedua dikaitkan dengan pengingat yang menyakitkan tentang ICU.1
Intervensi untuk mengurangi perkembangan Sindrom Pascarawat Intensif di Keluarga masih dalam penyelidikan. Kegunaan buku harian yang ditulis oleh anggota keluarga masih dieksplorasi, tetapi mungkin terkait dengan penurunan tingkat PTSD. Selain itu, kehadiran keluarga di ruang ICU dapat meningkatkan komunikasi dan mengurangi kecemasan pada anggota keluarga. Pada akhirnya, hasil yang buruk pada pengasuh tidak hanya membahayakan kesehatan mereka sendiri, tetapi juga kesehatan pasien. Oleh karena itu, perluasan evaluasi Sindrom Pascarawat Intensif kepada anggota keluarga harus dipertimbangkan jika memungkinkan.1
Toksisitas Finansial
Pasien yang selamat dari ICU mungkin mengalami toksisitas finansial yang signifikan. Kurang dari setengah dari pasien yang sebelumnya bekerja dan selamat dari ICU kembali bekerja 1 tahun setelah penyakit kritis, dan sekitar sepertiga pasien tetap menganggur setelah 5 tahun. Para pengasuh, yang biasanya adalah anggota keluarga, juga sering kali dibebani dengan tantangan pekerjaan; hingga 50% pengasuh melaporkan mengurangi jam kerja mereka atau berhenti bekerja untuk memberikan perawatan. Akibatnya, pengangguran dapat menyebabkan menipisnya tabungan, hilangnya jaminan perawatan kesehatan, dan tagihan medis yang membengkak. Yang penting, hubungan antara stabilitas keuangan dan pemulihan bersifat dua arah; tingkat dasar kenyamanan keuangan pada pasien dan keluarga mereka dikaitkan dengan tingkat stres keuangan setelah rawat inap, yang pada gilirannya dikaitkan dengan kesehatan mental global. dan akses ke rehabilitasi tambahan.1
Kesetaraan Kesehatan
Kesenjangan kesehatan memperburuk dan diperparah oleh Sindrom Pascarawat Intensif. Dinamika yang dapat mempengaruhi kejadian dan pemulihan dari Sindrom Pascarawat Intensif dapat dikategorikan ke faktor individu, masyarakat, sistem kesehatan, dan tingkat kebijakan. Penting untuk dicatat bahwa ada hubungan yang kompleks antara faktor-faktor ini dan pemulihan dari penyakit kritis.1
Usia, jenis kelamin, ras, dan pendapatan adalah beberapa faktor penentu sosial kesehatan individu yang terkait dengan hasil jangka panjang. Di Amerika Serikat, pendapatan yang rendah pada orang dewasa tua, dikaitkan dengan 28% beban disabilitas yang lebih besar dan hampir 10 kali lipat lebih besar dari penurunan kognitif bila dibandingkan dengan orang dewasa tua dengan pendapatan menengah ke atas. Pendidikan juga merupakan faktor penting, dengan tingkat pendidikan yang lebih tinggi dikaitkan dengan peluang yang lebih besar untuk bebas dari Sindrom Pascarawat Intensif. Perbedaan rasial juga semakin diakui. Sebuah studi kohort retrospektif menemukan bahwa pasien kulit hitam memiliki peluang 52% lebih tinggi untuk dirawat kembali karena sepsis dibandingkan dengan pasien kulit putih. Ras non-Kulit Putih juga dikaitkan dengan peningkatan risiko gangguan kognitif jangka panjang. Kesenjangan ini mungkin telah melebar selama pandemi COVID-19; jika dibandingkan dengan individu berkulit putih, individu berkulit hitam, Hispanik, dan Asia-Amerika telah menunjukkan tingkat yang lebih tinggi untuk masuk ICU untuk COVID-19 dan kemungkinan hasil yang lebih buruk.1
Di tingkat masyarakat, beberapa indeks status sosial ekonomi berbasis wilayah yang berbeda telah dikaitkan dengan hasil yang lebih buruk. Sebuah tinjauan sistemik menunjukkan bahwa posisi sosioekonomi yang lebih rendah dikaitkan dengan kematian di seluruh kontinum penyakit kritis, termasuk kematian di ICU, rawat inap, 30 hari, dan jangka panjang yang lebih tinggi.1
Ketidakberuntungan sosio-ekonomi di lingkungan sekitar, yang diukur dengan indeks deprivasi wilayah, dikaitkan dengan beban disabilitas yang lebih tinggi pada tahun setelah penyakit kritis. Demikian pula, faktor interpersonal seperti isolasi sosial dikaitkan dengan peningkatan beban disabilitas.1
Dari sudut pandang sistem dan kebijakan kesehatan, akses terbatas ke rehabilitasi tambahan, layanan tambahan, dan sumber daya sosial dapat menghambat pemulihan. Lebih khusus lagi, akses ke klinik Sindrom Pascarawat Intensif sangat bervariasi. Di Amerika Serikat, klinik Sindrom Pascarawat Intensif sebagian besar terkait dengan rumah sakit akademis besar dan bergantung pada pendanaan diskresioner dan kesukarelaan penyedia layanan, yang sering kali membatasi cakupan layanan yang dapat mereka berikan. Beberapa langkah untuk mengatasi ketidakadilan struktural dalam pemulihan penyakit kritis telah menunjukkan hasil yang menjanjikan; bukti dari intervensi kesejahteraan sosial di Inggris menunjukkan bahwa intervensi terstruktur yang mencakup saran perawatan sosial dan keuangan dapat meningkatkan hasil. Namun, penelitian lebih lanjut diperlukan untuk mengurai mekanisme yang beragam dan kompleks yang mendasari ketidaksetaraan kesehatan dan untuk menginformasikan perubahan kebijakan di masa mendatang.1
Klinik Sindrom Pascarawat Intensif
Program pemulihan ICU multidisiplin telah dibuat untuk mengatasi berbagai gangguan jangka panjang yang terlihat pada pasien yang selamat dari penyakit kritis. Saat ini, terdapat heterogenitas yang substansial dalam hal ketersediaan klinik, struktur, dan model staf. Selain itu, data mengenai efektifitas klinik pascarawat Intensif dalam mengurangi angka kematian dan meningkatkan kualitas hidup manusia masih terbatas. Namun demikian, tindak lanjut di klinik Sindrom Pascarawat Intensif saat ini direkomendasikan dalam Pedoman Kampanye Selamat dari Sepsis 2021, dan meskipun tidak ada kriteria rujukan pasien yang pasti, pasien yang paling sering ditemui di klinik Sindrom Pascarawat Intensif adalah orang dewasa yang selamat dari ICU yang membutuhkan ventilasi mekanis. Society of Critical Care Medicine menyarankan penilaian awal dalam waktu 2 hingga 4 minggu setelah keluar dari rumah sakit, dengan kunjungan berikutnya setelah terjadi perubahan kesehatan dan kehidupan yang signifikan.1,22,23
Mengatur kunjungan rawat jalan awal bisa penuh dengan tantangan karena banyak sekali hambatan untuk melakukan penanganan. Faktor-faktor tingkat pasien dapat mencakup usia lanjut, tingkat keparahan penyakit ICU yang lebih tinggi, dan disabilitas. Hambatan finansial dan lingkungan dapat berupa kurangnya asuransi, biaya transportasi, dan jarak ke klinik. Selain itu, banyak pasien yang dipindahkan dari rumah sakit ke pusat rehabilitasi sebelum pulang ke rumah, yang juga dapat mengurangi kemungkinan tindak lanjut, terutama dalam waktu 4 minggu setelah keluar dari rumah sakit. Karena alasan ini, petugas yang bertanggung jawab di pemulangan pasien dapat memfasilitasi untuk tindak lanjut.1,24
Untuk menangani semua komponen Sindrom Pascarawat Intensif, pendekatan multidisiplin dengan rujukan terpadu jalur ke praktisi layanan primer dan subspesialis inti adalah ideal. Meskipun susunan tim klinik yang optimal belum ditetapkan, tim ini harus mencakup dokter yang dapat menilai kecacatan fisik, gangguan kognitif, dan gejala sisa psikologis penyakit kritis. Di Amerika Serikat, tim klinik Sindrom Pascarawat Intensif paling sering terdiri dari dokter, apoteker, pekerja sosial, manajer kasus, terapis fisik, dan praktisi tingkat lanjut, sehingga mencerminkan adanya heterogenitas akan kebutuhan institusi dan ketersediaan sumber daya. Meskipun spesialisasi yang paling tepat untuk memimpin klinik ini juga tidak disepakati secara luas, memasukkan ahli intensivis ke dalam klinik dapat memfasilitasi perawatan jangka panjang dengan manfaat tambahan berupa umpan balik untuk perbaikan di ICU itu sendiri.1,24
Evaluasi Sindrom Pascarawat Intensif
Mendiagnosis Sindrom Pascarawat Intensif merupakan suatu tantangan karena kegagalan pengenalan dini dan kurangnya alat skrining untuk pasien-pasien ini. Penilaian serial dengan menggunakan anamnesis, pemeriksaan fisik, investigasi (jika diperlukan), dan konsultasi multidisiplin antara spesialis dan terapis sangat penting untuk mengevaluasi domain Sindrom Pascarawat Intensif secara sistematis.20
Tabel 1. Alat diagnostik untuk menilai Sindrom Pascarawat Intensif
|
Kategori |
Metode |
Konten |
Rentang Skor |
Nilai Batas |
|
|---|---|---|---|---|---|
|
Fisik |
Kekuatan |
Skor MRC |
MMT dalam 12 poin |
12-60 |
ICU-AW (<48) |
|
Kekuatan |
- |
- |
- |
||
|
Fungsi fisik |
Tes jalan kaki |
Jarak tempuh |
- |
Skor relatif |
|
|
EQ-5D-5L |
5 tingkat keparahan |
0-1 |
Nilai berbeda |
||
|
SF-36 |
36 item |
0-100 |
Perubahan |
||
|
Indeks |
Skala ADL 10 item |
0-100 |
Independensi |
||
|
FIM |
13 item |
13-91 |
- |
||
|
Kognitif |
Demensia |
Tes MoCA |
8 item |
0-30 |
Ringan (18–25), |
|
MMSE |
11 item |
0-30 |
Ringan (<24), |
||
|
Mini-Cog |
Mengingat 3 item dan |
0-5 |
Disfungsi |
||
|
SMQ |
14 item |
4-46 |
<40 |
||
|
IQCODE |
26 item |
0-3 |
≥1 |
||
|
Kesehatan |
Kecemasan |
HADS |
14 item |
0-14 |
≥8 |
|
SAS dan SDS |
20 item |
20-80 |
Kecemasan (>45), |
||
|
Depresi |
PHQ-9 |
9 item |
0-27 |
≥10 |
|
|
PHQ-2 |
2 item |
0-6 |
≥2 |
||
|
PTSD |
IES-R |
22 item |
0-4 |
>1,6 (rata-rata) |
|
|
IES-6 |
6 item |
0-4 |
>1,75 (rata-rata) |
||
|
PCL-5 |
20 item |
0-80 |
≥31-33 |
||
Dikutip dan dimodifikasi dari: Nakanishi N, Liu K, Kawakami D, et al. Post-intensive care syndrome and its new challenges in coronavirus disease 2019 (COVID-19) pandemic: a review of recent advances and perspectives. J Clin Med. 2021;10(3870):1-17.
Evaluasi dan manajemen Sindrom Pascarawat Intensif terus berkembang, dengan rekomendasi saat ini sebagian besar didasarkan pada pendapat para ahli dan pengalaman penyedia layanan. Setiap domain Sindrom Pascarawat Intensif harus dievaluasi secara terstruktur, karena jika tidak, gangguan yang lebih halus dapat terlewatkan. Penilaian awal juga harus mencakup rekonsiliasi pengobatan yang lengkap, evaluasi untuk gejala baru atau gejala yang menetap, skrining kesenjangan perawatan kesehatan, dan penempatan rujukan yang diindikasikan secara klinis. Selain itu, penerimaan pasien di ICU harus ditinjau dengan pasien secara terperinci, serta alur pemulihan yang diharapkan.1
Mengingat sifat Sindrom Pascarawat Intensif yang memiliki banyak aspek, kunjungan tindak lanjut yang benar-benar komprehensif mungkin sulit dilakukan di pusat-pusat yang tidak memiliki klinik Sindrom Pascarawat Intensif khusus. Dalam kondisi ini, dokter rawat jalan lain yang merawat pasien yang selamat dari ICU harus memasukkan elemen evaluasi Sindrom Pascarawat Intensif ke dalam praktik mereka jika memungkinkan.1
Tata Laksana Sindrom Pascarawat Intensif
Penanganan Sindrom Pascarawat Intensif dibagi menjadi dua bagian: selama di ICU dan pascarawat inap di ICU. Para intensivis dapat mengurangi risiko Sindrom Pascarawat Intensif dengan meminimalkan sedasi, menghindari penggunaan psikotropika termasuk antipsikotik dan agen antikolinergik, menghindari hipoglikemia dan hipoksemia, modifikasi lingkungan, serta memprioritaskan rehabilitasi fisik dan mobilitas dini untuk pasien yang lebih tua. Pendekatan bundel ABCDEF terbukti mengurangi kemungkinan kematian dalam waktu 7 hari, ventilasi mekanis, koma, delirium, dan penggunaan pengekangan fisik.20
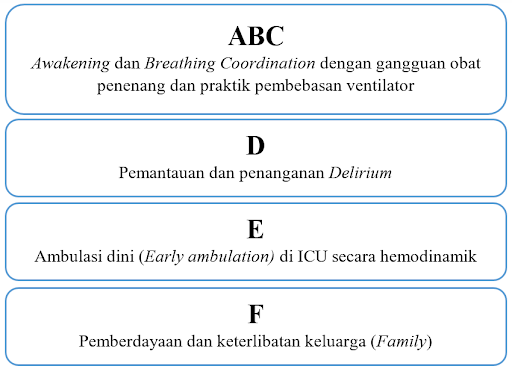
Dikutip dan dimodifikasi dari: Ahmad M, Teo S. Post-intensive Care Syndrome. Ann Geriatr Med Res. 2021;25(2):75-8.
Domain Kognitif
Idealnya, serangkaian jenis pemeriksaan harus digunakan untuk men-skrining defisit kognitif, karena pemeriksaan tersebut menghasilkan informasi yang berbeda dan dapat memastikan bahwa pasien menerima perawatan yang tepat. Gejala kognitif subyektif seperti kelupaan atau peningkatan ketergantungan pada pengasuh dapat mengindikasikan penurunan kognitif, tetapi catatan yang diingat ini harus disertai dengan penilaian berbasis kinerja yang terstandarisasi dalam bahasa asli pasien, dengan menggunakan penerjemah seperti yang diindikasikan. Para ahli merekomendasikan penggunaan Penilaian Kognitif Montreal atau Penilaian Kognitif Montreal-Buta untuk digunakan untuk melakukan skrining gangguan kognitif, meskipun Mini-Mental State Examination dan tes Pembuatan Jejak juga umum digunakan. Meskipun terdapat berbagai macam penilaian untuk menilai partisipasi dalam aktivitas, seperti Skala Aktivitas Kehidupan Sehari-hari Katz, Indeks Barthel, dan Skala Aktivitas Instrumental Aktivitas Kehidupan Sehari-hari Lawton, penilaian yang optimal belum ditetapkan.1,25
Langkah awal dalam menangani disfungsi kognitif adalah mengevaluasi dan mengelola penyebab yang berpotensi reversibel. Ini termasuk, tetapi tidak terbatas pada, efek samping obat, gangguan tidur, kondisi psikologis, dan gangguan metabolisme atau nutrisi. Setelah penyebab yang dapat dibalikkan diatasi, pilihan pengobatan lain dapat dipertimbangkan. Meskipun bukti mengenai pendekatan dan intensitas pengobatan kognitif khusus untuk pasien yang selamat dari ICU masih terbatas, metode pelatihan yang digunakan untuk populasi lain (misalnya, orang dengan gangguan kognitif ringan dan cedera otak yang didapat) menunjukkan kemungkinan manfaat pelatihan ulang kognitif dan strategi kompensasi pada hasil kognitif dan fungsi sehari-hari. Edukasi mengenai strategi kompensasi dapat diberikan selama kunjungan klinik; tetapi, pelatihan ulang kognitif biasanya memerlukan rujukan untuk terapi okupasi yang berkelanjutan. Rencana dan tujuan pengobatan harus menargetkan gangguan spesifik pasien dan harus terdiri dari kombinasi strategi dan pelatihan untuk mendapatkan kembali atau meningkatkan partisipasi yang bermakna dalam kegiatan sehari-hari. Efek intervensi kognitif pada hasil pasien yang bertahan hidup di ICU menunjukkan bahwa intensitas perawatan dan penggunaan strategi pelatihan kompensasi dapat memperbaiki luaran.1,25,26
Selain itu, penelitian telah menunjukkan manfaat latihan fisik pada fungsi kognitif pada tingkat sel dan struktural, serta pada fungsi dan perilaku. Aktivitas fisik dan olahraga telah terbukti memperlambat penurunan kognitif, bahkan meningkatkan hasil kognitif, bagi individu dengan gangguan kognitif ringan. Meskipun protokol olahraga yang spesifik (yaitu, frekuensi, intensitas, waktu, dan jenis) untuk mendapatkan perubahan kognisi yang bermakna secara klinis tidak diketahui, bahkan seberapa banyak olahraga minimal telah dikaitkan dengan perubahan kognisi yang bermakna secara klinis, mendukung pernyataan dari Organisasi Kesehatan Dunia ini memberikan pedoman bahwa untuk semua populasi, "sedikit aktivitas fisik lebih baik daripada tidak sama sekali dan lebih banyak aktivitas fisik lebih baik untuk hasil kesehatan yang optimal."1,27
Domain Psikologi
Skrining kesehatan mental harus dilakukan melalui wawancara klinis dan kuesioner terstruktur. Society of Critical Care Medicine merekomendasikan penggunaan Skala Kecemasan dan Depresi Rumah Sakit untuk mengevaluasi kecemasan dan depresi serta Impact of Events Scaled-Revised-6 untuk mengevaluasi PTSD. Kelompok lain telah menggunakan kuesioner alternatif pada pasien yang bertahan hidup di ICU dengan sukses, termasuk Medical Outcomes Study Short Form 36, Beck Depression Inventory, Beck Anxiety Inventory, PTSD Checklist, dan Posttraumatic Stress Syndrome 10-Questions Inventory.1,10,28
Beberapa pusat pascarawat intensif menawarkan kelompok dukungan sebaya baik melalui platform langsung maupun virtual, yang dapat memberikan sejumlah manfaat bagi pasien. Penting juga bagi dokter untuk memberikan konseling kepada pasien mengenai alur pemulihan yang diharapkan, menormalkan pengalaman mereka, dan memvalidasi kemajuan mereka. Pasien dengan gangguan psikologis yang menetap dapat memperoleh manfaat dari rujukan ke ahli kesehatan jiwa untuk mendapatkan penanganan yang tepat.1
Pasien dengan depresi dapat diobati dengan antidepresan atau psikoterapi saja, atau dalam kombinasi, yang mungkin lebih berefek.1
Untuk kecemasan, terapi perilaku kognitif tetap menjadi pilihan psikoterapi lini pertama, meskipun terapi berbasis kognitif semakin mendapat perhatian dan mungkin lebih memungkinkan untuk dilakukan sendiri oleh pasien selama masa pemulihan awal.1
Farmakoterapi untuk gangguan kecemasan umum juga dapat dipertimbangkan. Pengobatan lini pertama untuk PTSD melibatkan terapi yang berfokus pada trauma seperti terapi perilaku kognitif dan terapi berbasis paparan, meskipun obat-obatan mungkin lebih memiliki untuk beberapa individu.1,29
Domain Fisik
Metode untuk mengevaluasi ICU-AW tidak disepakati secara luas. Alat yang sering digunakan termasuk pemeriksaan otot secara manual, dinamometri genggaman tangan, tes lima kali duduk-berdiri, dan Skala Keseimbangan Berg. Tes jalan kaki 6 menit direkomendasikan oleh Society of Critical Care Medicine sebagai alat ukur fungsi paru dan fisik. Spirometri di samping tempat tidur atau tes fungsi paru lengkap juga dapat berguna, terutama untuk yang bertahan dari ARDS.16,23
Karena berbagai jenis gangguan fisik dapat terjadi setelah penyakit kritis, masalah yang sering ditemui, seperti kondisi kronis yang baru didiagnosis, gangguan tidur, serta luka serta alat-alat yang dipakaikan di ICU, juga harus ditangani.1
Edukasi pasien dan keluarga mengenai alat bantu mobilitas, penyesuaian lingkungan, dan layanan rehabilitasi berbasis komunitas harus diberikan selama kunjungan klinik. Pasien juga harus diberi tahu tentang pentingnya program latihan bertahap untuk meningkatkan toleransi latihan dan mengurangi rasa tidak nyaman setelah berolahraga setelah dirawat di ICU dalam waktu yang lama. Selain itu, meskipun data mengenai rehabilitasi untuk ICU-AW masih terbatas, terapi fisik dan okupasi dapat berguna bagi pasien yang mengalami gejala yang berkelanjutan.1
Untuk pasien dengan gejala paru yang sedang berlangsung, edukasi yang berfokus pada kesadaran pola pernapasan disfungsional dan menggunakan metode seperti pursed-lip breathing dapat membantu meringankan gejala. Meskipun tidak diteliti pada populasi yang pernah dirawat di ICU, jenis teknik pernapasan terkontrol ini telah terbukti dapat meringankan dispnea, kecemasan, dan mobilitas secara signifikan pada pasien dengan penyakit paru-paru kronis.30
Selain itu, meskipun banyak pasien yang terus menerima oksigen tambahan setelah keluar dari rumah sakit, kebutuhan mereka sering berubah seiring waktu; tes berjalan 6 menit dapat digunakan untuk memandu titrasi oksigen pada kunjungan awal dan kunjungan lanjutan. Pasien juga harus diedukasi mengenai penyapihan oksigen dan harus didorong untuk proaktif dalam proses ini, dengan memastikan untuk tidak menggunakan oksigen secara berlebihan dengan menggunakan aliran minimum untuk mempertahankan target saturasi oksigen.1,31
Terakhir, rujukan ke program rehabilitasi paru dapat bermanfaat dalam mengurangi beban gejala, meningkatkan kapasitas latihan, dan meningkatkan kualitas hidup.1,32
Ringkasan
Kelangsungan hidup di ICU sering kali dipersulit oleh Sindrom Pascarawat Intensif, yang menyebabkan gangguan fisik, kognitif, dan psikologis serta morbiditas yang substansial. Dampaknya tidak hanya dirasakan oleh pasien, tetapi juga oleh keluarga, sistem perawatan kesehatan, dan masyarakat secara keseluruhan. Klinik pascarawat intensif merupakan sarana yang penting untuk mengevaluasi dan mengelola Sindrom Pascarawat Intensif dan juga dapat menjadi cara untuk meningkatkan perawatan di ICU.1
Tujuan perawatan intensif seharusnya tidak hanya berfokus pada kelangsungan hidup di ICU dan bertujuan untuk memberikan kualitas hidup terbaik bagi pasien yang sakit kritis. Hal ini mencakup pencegahan, pengobatan dan/atau peringanan dampak jangka panjang yang diakibatkan oleh rawat inap di ICU. Permasalahan multiorgan yang kompleks dan sebagian besar respons yang dipicu oleh penyakit kritis membuat sulit untuk menemukan pengobatan yang menghasilkan manfaat klinis.4
- Schwitzer E, Jensen K, Brinkman L, et al. Survival Recovery: A Narrative Review of Post-Intensive Care Syndrome. Chest. 2023;1(1):1-14.
- Cuthbertson B, Scott J, Strachan M, Kilonzo M, Vale L. Quality of life before and after intensive care. Anaesthesia. 2005;60(4):332-9.
- Lilly C, Swami S, Liu X, Riker R, Badawi O. Five-year trends of critical care practice and outcomes. Chest. 2017;152(4):723-5.
- Martin-Vicente P, López Martínez C, Lopez Alonso I, López Aguilar J, Albaiceta G, Amado Rodríguez L. Molecular mechanisms of postintensive care syndrome. Intensive Care Med Exp. 2021;9(58):1-17.
- van Beusekom I, Bakhshi-Raiez F, de Keizer N, Dongelmans D, van der Schaaf M. Reported burden on informal caregivers of ICU survivors: a literature review. Crit Care. 2016;20:16.
- Danesh V, Boehm L, Eaton T, et al. Characteristics of post-ICU and post-COVID recovery clinics in 29 U.S. health systems. Crit Care Explor. 2022;4(3):e0658.
- Nakanishi N, Liu K, Kawakami D, et al. Post-Intensive Care Syndrome and Its New Challenges in Coronavirus Disease 2019 (COVID-19) Pandemic: A Review of Recent Advances and Perspectives. J Clin Med. 2021;10(3870):1-17.
- Marra A, Pandharipande P, Girard T, et al. Co-occurrence of post-intensive care syndrome problems among 406 survivors of critical illness. Crit Care Med. 2018;46(9):1393-401.
- Sakusic A, Rabinstein A. Cognitive outcomes after critical illness. Curr Opin Crit Care. 2018;24(5):410-4.
- Jackson J, Pandharipande P, Girard T, et al. Depression, posttraumatic stress disorder, and functional disability in survivors of critical illness in the BRAIN-ICU study: a longitudinal cohort study. Lancet Respir Med. 2014;2(5):369-79.
- Duggan M, Wang L, Wilson J, Dittus R, Ely E, Jackson J. The relationship between executive dysfunction, depression, and mental health-related quality of life in survivors of critical illness: results from the BRAIN-ICU investigation. J Crit Care. 2017;37:72-9.
- Girard T, Jackson J, Pandharipande P, et al. Delirium as a predictor of long-term cognitive impairment in survivors of critical illness. Crit Care Med. 2010;38(7):1513-20.
- Patel B, Wolfe K, Patel S, et al. Effect of early mobilisation on long-term cognitive impairment in critical illness in the USA: a randomised controlled trial. Lancet Respir Med. 2023;11(6):563-72.
- Hatch R, Young D, Barber V, Griffiths J, Harrison D, Watkinson P. Anxiety, depression and post traumatic stress disorder after critical illness: a UK-wide prospective cohort study. Crit Care. 2018;22(1):310.
- Altman M, Knauert M, Pisani M. Sleep disturbance after hospitalization and critical illness: a systematic review. Ann Am Thorac Soc. 2017;14(9):1457-68.
- Ohtake P, Lee A, Scott J, et al. Physical impairments associated with post-intensive care syndrome: systematic review based on the World Health Organization’s International Classification of Functioning, Disability and Health Framework. Phys Ther. 2018;98(8):631-45.
- Koch S, Wollersheim T, Bierbrauer J, et al. Long-term recovery In critical illness myopathy is complete, contrary to polyneuropathy. Muscle Nerve. 2014;50(3):431-6.
- Herridge M, Tansey C, Matte A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med. 2011;364(14):1293-304.
- Brown K, Agrawal S, Kirschen M, et al. The brain in pediatric critical care: unique aspects of assessment, monitoring, investigations, and follow up. Intensive Care Med. 2022;48(5):535-47.
- Ahmad M, Teo S. Post-intensive Care Syndrome. Ann Geriatr Med Res. 2021;25(2):75-8.
- Wang S, Allen D, Kheir Y, Campbell N, Khan B. Aging and post-intensive care syndrome (PICS): a critical need for Geriatrikc psychiatry. Am J Ger Psych. 2017;26(2):212-21.
- Evans L, Rhodes A, Alhazzani W, et al. Executive summary: Surviving Sepsis Campaign: international guidelines for the management of sepsis and septic shock 2021. Crit Care Med. 2021;49(11):1974-82.
- Mikkelsen M, Still M, Anderson B, et al. Society of Critical Care Medicine’s International Consensus Conference on Prediction and Identification of Long-Term Impairments After Critical Illness. Crit Care Med. 2020;48(11):1670-9.
- Bloom S, Stollings J, Kirkpatrick O, et al. Randomized clinical trial of an ICU recovery pilot program for survivors of critical illness. Crit Care Med. 2019;47(10):1337-45.
- Petersen R, Lopez O, Armstrong M, et al. Author response: practice guideline update summary: mild cognitive impairment: report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2018;91(8):373-4.
- Muradov O, Petrovskaya O, Papathanassoglou E. Effectiveness of cognitive interventions on cognitive outcomes of adult intensive care unit survivors: a scoping review. Aust Crit Care. 2021;34(5):473-85.
- Bull F, Al-Ansari S, Biddle S, et al. World Health Organization 2020 guidelines on physical activity and sedentary behaviour. Br J Sports Med. 2020;54(24):1451-62.
- Pfoh E, Chan K, Dinglas V, et al. The SF-36 offers a strong measure of mental health symptoms in survivors of acute respiratory failure. a tri-national analysis. Ann Am Thorac Soc. 2016;13(8):1343-50.
- Guideline Development Panel for the Treatment of PTSD in Adults, American Psychological Association. Summary of the clinical practice guideline for the treatment of posttraumatic stress disorder (PTSD) in adults. Am Psychol. 2019;74(5):569-607.
- Valenza M, Valenza-Pena G, Torres-Sanchez I, Gonzalez-Jimenez E, Conde-Valero A, Valenza-Demet G. Effectiveness of controlled breathing techniques on anxiety and depression in hospitalized patients with COPD: a randomized clinical trial. Respir Care. 2014;59(2):205-15.
- ATS Committee on Proficiency Standards for Clinical Pulmonary Function Laboratories. ATS statement: guidelines for the sixminute walk test. Am J Respir Crit Care Med. 2002;166(1):111-7.
- Singh S, Halpin D, Salvi S, Kirenga B, Mortimer K. Exercise and pulmonary rehabilitation for people with chronic lung disease in LMICs: challenges and opportunities. Lancet Respir Med. 2019;7(12):1002-4.
Ramadhan MF. Sindrom Pascarawat Intensif. Refarat. Universitas Hasanuddin. 2023
